權(quán)利要求
1.一種高砷水凈化工藝��,其特征在于�,包括以下步驟:
S1��、在廢水中加入Ca(OH)2,廢水中的鐵與廢水中AsO33-�、AsO43-形成穩(wěn)定的絡(luò)合物�,并被鐵的氫氧化物吸附共沉去除部分砷;
主要反應(yīng)為:Ca(OH)2+FeSO4=CaSO4+Fe(OH)2;
Ca(OH)2+Fe2(SO4)3=CaSO4+Fe(OH)3;
AsO43-+Fe(OH)3=FeAsO4+3OH-;
AsO33-+Fe(OH)3=FeAsO3+3OH-;
其中Fe2+有很強的還原性�����,在溶液中很容易被氧化為Fe3+;
S2、在廢水中添加曝氣裝置除鐵;
主要反應(yīng)為:4Fe2++O2+4H+→2Fe3++2H2O;
2Fe3++SO42-+3Ca(OH)2+6H2O→2Fe(OH)3+3CaSO4·2H2O;
S3�����、在S2上清液中,先根據(jù)銅元素含量添加硫氫化鈉��,完全回收銅��,此步會同時沉下來少部分砷與鋅到銅精礦���,然后根據(jù)鋅元素含量再次添加硫氫化鈉����,此時水質(zhì)中鋅�、砷均回收完全����,NaHS先將As5+還原為As3+�、As3+再進一步與硫氫化鈉反應(yīng)生成As2S3沉淀��,從而達到完全凈化高砷水的目的;
主要反應(yīng)為:Cu2++HS-=H++CuS;
Zn2++HS-=H++ZnS;
NaHS+H3AsO4=H3AsO3+S+NaOH;
3NaHS+2H3AsO3=As2S3+3NaOH+3H2O。
2.根據(jù)權(quán)利要求1所述的一種高砷水凈化工藝�����,其特征在于,所述S3中根據(jù)銅元素含量按140%的加藥比例添加硫氫化鈉���。
3.根據(jù)權(quán)利要求1所述的一種高砷水凈化工藝,其特征在于��,所述S3中根據(jù)鋅元素含量按600%加藥比例添加硫氫化鈉。
說明書
技術(shù)領(lǐng)域
[0001]本發(fā)明涉及高砷水凈化技術(shù)領(lǐng)域�,具體涉及一種高砷水凈化工藝����。
背景技術(shù)
[0002]銅�����、鉛、鋅等重金屬的礦物大多數(shù)是以硫化物的形式存在����,在冶煉過程中��,這些硫化物的硫被充分利用制成工業(yè)硫酸或者其他制品����。而在生產(chǎn)工業(yè)硫酸時會產(chǎn)生一定量的酸性廢水����,含砷高達3000mg/L以上��,必須要經(jīng)過處理后,才能外排或者回收利用�。
[0003]在文獻(申請?zhí)枮椋篊N201110270354.4)中����,公開了一種高砷污酸廢水的處理方法,采用以下三個步驟:①硫化反應(yīng):在高砷污酸廢水中加入硫化鈉溶液,攪拌��,使高砷污酸廢水的砷、鉛����、鎘金屬離子以硫化物的形式沉淀下來,硫化鈉的加入量����,根據(jù)其砷、鉛�����、鎘重金屬的含量按下反應(yīng)方程計算出����,并過量10-20%;硫化鈉溶液加完畢后再攪拌30分鐘,然后泵入壓濾機壓濾;壓濾后的硫化渣堆存����,待回收砷等金屬;硫化反應(yīng)的濾液泵入一次中和反應(yīng)槽;
②一次中和反應(yīng):在硫化反應(yīng)的濾液中加入石灰乳��,并攪拌�����,當pH值達到8時陸續(xù)加入聚合鐵溶液,進一步除去廢水中的砷;聚合鐵的加入量按每立方硫化反應(yīng)的濾液加0.8Kg計算,繼續(xù)加入石灰乳;當pH值達到10時停止加入石灰乳,繼續(xù)攪拌30分鐘,壓濾;壓濾后的一次中和渣堆存�,中和濾液泵入強化反應(yīng)槽;
③強化中和反應(yīng):在強化反應(yīng)槽中��,按每立方中和濾液0.5kg聚合鐵的比例加入聚合鐵溶液�,攪拌;再用石灰乳調(diào)整反應(yīng)槽溶液的pH值�,當pH值達到8-9時停止加入石灰乳�����,繼續(xù)攪拌30分鐘;然后按槽內(nèi)溶液量的0.02%加入PAM絮凝劑,繼續(xù)攪拌10分鐘后壓濾;壓濾后的強化中和濾渣堆存�,強化中和濾液經(jīng)檢驗泵入總廢水站進一步處理后達到合格排放的標準后�����,排放。
[0004]該專利采用硫化鈉進行除砷���,硫化鈉沉砷的藥劑用量��、pH值��、反應(yīng)時間沒有控制好�����,都會導(dǎo)致硫化鈉的除砷率顯著降低;
(1)硫化鈉的用量:文獻資料和生產(chǎn)實踐均表明�����,一次沉砷����,即使硫化鈉過量很多倍�����,也不能將砷脫除到很低的水平;
(2)pH值:硫化鈉沉砷在酸性條件下進行�,當pH值為2左右�,沉砷效果最好;當污水中砷含量過高��,沉砷效率降低;當硫化鈉過量時��,堿性較強時,吸附劑表面所帶負電荷增多�,負電荷之間的靜電斥力增加,吸附量減少���,沉砷效率降低;
(3)反應(yīng)時間:硫化鈉沉砷過程屬于離子反應(yīng),反應(yīng)過程十分迅速����,沉砷時間應(yīng)控制在40-60min左右��,但生產(chǎn)實踐中由于受客觀條件的限制使得反應(yīng)時間過長����,溶液中存在高價氧化態(tài)離子將三硫化二砷沉淀重新溶解����,導(dǎo)致除砷率反而下降���。
[0005]在文獻(申請?zhí)枮椋篊N202110533331.1)中,公開了一種高濃度含砷污酸的處理工藝���,包括以下步驟:步驟S10����,將高濃度污酸原液經(jīng)過濾器過濾后引入污酸儲槽���,攪拌混合�,靜置2~4小時;
步驟S20��,將硫氫化鈉加入到硫化氫氣體發(fā)生器���,加入濃度為50%的稀硫酸溶液����,硫酸與硫氫化鈉進行氣體發(fā)生反應(yīng)�,生產(chǎn)硫化氫氣體和硫酸鈉;步驟S30�,經(jīng)沉降固液分離后將污酸儲槽的液體通過離心泵引入到硫化反應(yīng)器����,再加入步驟S20得到的硫化氫氣體�,通過反應(yīng)器的內(nèi)循環(huán)泵對高濃度含砷污酸進行內(nèi)循環(huán),使硫化氫氣體與液體中的重金屬進行反應(yīng),產(chǎn)生沉淀;步驟S40,當反應(yīng)達到終點時���,通過排液泵打入濃密池�,再經(jīng)壓濾機處理�����,實現(xiàn)固液分離��,實現(xiàn)污酸的達標排放。
[0006]該工藝雖然采用了硫氫化鈉��,但是需要將硫氫化鈉氣化���,工藝步驟繁瑣�,且無法準確控制硫氫化鈉添加量��,容易造成浪費���,同時廢水中通常還含有銅����、鋅元素���,該工藝處理時無法回收其中的銅與鋅,無法充分處理與利用廢水資源�。
發(fā)明內(nèi)容
[0007]本發(fā)明的目的在于:為解決上述問題����,本發(fā)明提供了一種高砷水凈化工藝�。
[0008]本發(fā)明為了實現(xiàn)上述目的具體采用以下技術(shù)方案:
一種高砷水凈化工藝��,包括以下步驟:
S1��、在廢水中加入Ca(OH)2,廢水中的鐵與廢水中AsO33-��、AsO43-形成穩(wěn)定的絡(luò)合物����,并被鐵的氫氧化物吸附共沉去除部分砷;
主要反應(yīng)為:Ca(OH)2+FeSO4=CaSO4+Fe(OH)2;
Ca(OH)2+Fe2(SO4)3=CaSO4+Fe(OH)3;
AsO43-+Fe(OH)3=FeAsO4+3OH-;
AsO33-+Fe(OH)3=FeAsO3+3OH-;
其中Fe2+有很強的還原性���,在溶液中很容易被氧化為Fe3+;
S2�����、在廢水中添加曝氣裝置除鐵;
主要反應(yīng)為:4Fe2++O2+4H+→2Fe3++2H2O;
2Fe3++SO42-+3Ca(OH)2+6H2O→2Fe(OH)3+3CaSO4·2H2O;
S3、在S2上清液中��,先根據(jù)銅元素含量添加硫氫化鈉�����,完全回收銅��,此步會同時沉下來少部分砷與鋅到銅精礦��,然后根據(jù)鋅元素含量再次添加硫氫化鈉,此時水質(zhì)中鋅�����、砷均回收完全���,NaHS先將As5+還原為As3+、As3+再進一步與硫氫化鈉反應(yīng)生成As2S3沉淀�����,從而達到完全凈化高砷水的目的;
主要反應(yīng)為:Cu2++HS-=H++CuS;
Zn2++HS-=H++ZnS;
NaHS+H3AsO4=H3AsO3+S+NaOH;
3NaHS+2H3AsO3=As2S3+3NaOH+3H2O。
[0009]進一步地�,所述S3中根據(jù)銅元素含量按140%的加藥比例添加硫氫化鈉�����。
[0010]進一步地,所述S3中根據(jù)鋅元素含量按600%加藥比例添加硫氫化鈉�。
[0011]本發(fā)明的有益效果如下:
1�、本發(fā)明通過氫氧化鈣的添加��,不僅能快速地吸附共沉去除部分砷��,且能去除廢水中的鐵元素,不會影響后續(xù)的銅精礦和鋅精礦回收����,然后再通過硫氫化鈉分批添加�,能依次回收上清液中的銅與鋅�,且能完全凈化高砷水��,處理全面,廢水利用率高���。
[0012]2、本發(fā)明通過上清液銅元素與鋅元素含量�����,能精確控制硫氫化鈉添加量,節(jié)省藥劑的同時�����,能最大程度的提高凈化效果�。
附圖說明
[0013]圖1是本發(fā)明工藝流程圖����。
具體實施方式
[0014]為使本發(fā)明實施例的目的����、技術(shù)方案和優(yōu)點更加清楚�����,下面將結(jié)合本發(fā)明實施例中的附圖���,對本發(fā)明實施例中的技術(shù)方案進行清楚�、完整地描述��。
[0015]以稀酸酸浸液廢水(含砷���、鐵���、銅���、鋅元素)為例;
廢水中砷主要以正亞砷酸和偏亞砷酸及它們的鹽類的形式存在,廢水中有下列電離平衡:
3H++AsO33-=As(OH)3= As3+ +3OH-;
5H++AsO43- = As5+ + 3OH-+H2O;
實施例一
[0016]如圖1所示����,一種高砷水凈化工藝,包括以下步驟:
S1��、在廢水中加入Ca(OH)2����,廢水中的鐵與廢水中AsO33-�、AsO43-形成穩(wěn)定的絡(luò)合物����,并被鐵的氫氧化物吸附共沉去除部分砷;
主要反應(yīng)為:Ca(OH)2+FeSO4=CaSO4+Fe(OH)2;
Ca(OH)2+Fe2(SO4)3=CaSO4+Fe(OH)3;
AsO43-+Fe(OH)3=FeAsO4+3OH-;
AsO33-+Fe(OH)3=FeAsO3+3OH-;
其中Fe2+有很強的還原性,在溶液中很容易被氧化為Fe3+��,這樣目的是先除去鐵����,為了方便后續(xù)分別回收銅精礦和鋅精礦;
S2�、在廢水中添加曝氣裝置除鐵;
主要反應(yīng)為:4Fe2++O2+4H+→2Fe3++2H2O;
2Fe3++SO42-+3Ca(OH)2+6H2O→2Fe(OH)3+3CaSO4·2H2O;
S3��、在S2上清液中�,先根據(jù)銅元素含量添加硫氫化鈉�,完全回收銅����,此步會同時沉下來少部分砷與鋅到銅精礦���,然后根據(jù)鋅元素含量再次添加硫氫化鈉����,此時水質(zhì)中鋅�����、砷均回收完全���,NaHS先將As5+還原為As3+、As3+再進一步與硫氫化鈉反應(yīng)生成As2S3沉淀��,從而達到完全凈化高砷水的目的;
主要反應(yīng)為:Cu2++HS-=H++CuS;
Zn2++HS-=H++ZnS;
NaHS+H3AsO4=H3AsO3+S+NaOH;
3NaHS+2H3AsO3=As2S3+3NaOH+3H2O。
實施例二
[0017]在上述實施例的基礎(chǔ)上�����,還包括��,S3中根據(jù)銅元素含量按140%的加藥比例添加硫氫化鈉����。
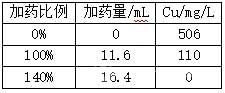
[0018]硫氫化鈉收銅探索
[0019]實施例三
在上述實施例的基礎(chǔ)上�����,還包括�����,S3中根據(jù)鋅元素含量按600%加藥比例添加硫氫化鈉。
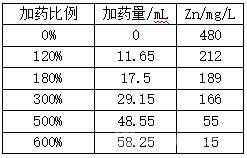
[0020]硫氫化鈉收鋅探索
[0021]500%-600%之間存在明顯顏色變深現(xiàn)象���。
[0022]綜上��,采用實施例二與實施例三中的添加比例得到實驗數(shù)據(jù)如下:
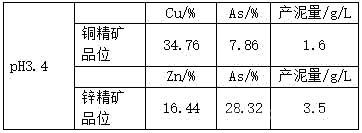
高砷水凈化實驗數(shù)據(jù);
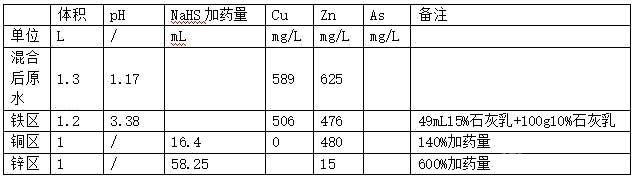
(1)取800mL原水+500mL稀酸酸浸液混合液��,測Cu(混合液就是高砷水);
(2)鐵區(qū):取其中1200mL,添加石灰乳至pH為3.0����,過濾后測Cu和Zn;
(3)銅區(qū):根據(jù)上步中得到的水樣體積和測得的Cu���,按照表中加藥比例添加NaHS收銅��,過濾后測Cu和Zn;
(4)鋅區(qū):根據(jù)上步中得到的水樣體積和測得的Zn���,按照表中加藥比例添加NaHS收鋅,過濾后測Zn;
實驗表格
[0023]實驗數(shù)據(jù)1
[0024]實驗數(shù)據(jù)2
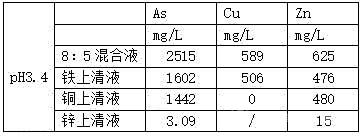
[0025]實驗數(shù)據(jù)3
[0026]因此采用本發(fā)明的凈化工藝�����,能準確控制藥劑用量、pH與反應(yīng)時間��,能充分回收利用高砷水中的資源。
[0027]對所公開的實施例的上述說明����,使本領(lǐng)域?qū)I(yè)技術(shù)人員能夠?qū)崿F(xiàn)或使用本發(fā)明�����。對這些實施例的多種修改對本領(lǐng)域的專業(yè)技術(shù)人員來說將是顯而易見的�����,本文中所定義的一般原理可以在不脫離本發(fā)明的精神或范圍的情況下��,在其它實施例中實現(xiàn)�����。因此,本發(fā)明將不會被限制于本文所示的這些實施例����,而是要符合與本文所公開的原理和新穎特點相一致的最寬的范圍���。
說明書附圖(1)
聲明:
“高砷水凈化工藝” 該技術(shù)專利(論文)所有權(quán)利歸屬于技術(shù)(論文)所有人����。僅供學(xué)習(xí)研究���,如用于商業(yè)用途,請聯(lián)系該技術(shù)所有人���。
我是此專利(論文)的發(fā)明人(作者)

 354
編輯:中冶有色技術(shù)網(wǎng)
來源:山東美華特水處理科技有限公司
354
編輯:中冶有色技術(shù)網(wǎng)
來源:山東美華特水處理科技有限公司


 分享 0
分享 0
 舉報 0
舉報 0
 收藏 0
收藏 0
 反對 0
反對 0
 點贊 0
點贊 0

 中冶有色技術(shù)平臺
中冶有色技術(shù)平臺 2025年03月28日 ~ 30日
2025年03月28日 ~ 30日  2025年03月28日 ~ 30日
2025年03月28日 ~ 30日  2025年04月11日 ~ 13日
2025年04月11日 ~ 13日  2025年04月11日 ~ 13日
2025年04月11日 ~ 13日  2025年04月27日 ~ 29日
2025年04月27日 ~ 29日 
