
全部
▼
搜索
熱搜:
位置:中冶有色 >
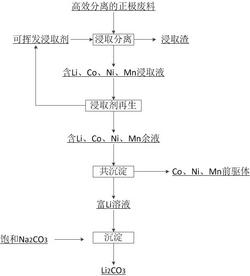
> 從鋰離子電池正極廢料中回收正極材料和碳酸鋰的方法
 478
編輯:中冶有色技術(shù)網(wǎng)
來源:中科過程(北京)科技有限公司
478
編輯:中冶有色技術(shù)網(wǎng)
來源:中科過程(北京)科技有限公司
 分享 0
分享 0
 舉報 0
舉報 0
 收藏 0
收藏 0
 反對 0
反對 0
 點贊 0
點贊 0

 2025年03月20日 ~ 22日
2025年03月20日 ~ 22日  2025年03月21日 ~ 23日
2025年03月21日 ~ 23日  2025年04月11日 ~ 13日
2025年04月11日 ~ 13日  2025年04月11日 ~ 13日
2025年04月11日 ~ 13日  2025年04月25日 ~ 27日
2025年04月25日 ~ 27日 
